近日,我校第一附属医院检验科周建博士与广州大学等单位合作在国际知名期刊《Nature Communications》发表了最新研究成果“Evolved cytidine and adenine base editors with high precision and minimized off-target activity by a continuous directed evolution system in mammalian cells”。该研究设计了一种基于哺乳动物的CRISPR/Cas碱基编辑器进化系统,大大提高了碱基编辑器的优化效率,对于基因编辑技术的进一步应用具有重要意义。

CRISPR/Cas技术是一种有效的碱基编辑器,然而人们在应用其进行基因编辑的过程中发现尚存在一系列问题。基于CRISPR/Cas碱基编辑系统存在的off target、Indel,以及编辑窗口内的非特异性的编辑,往往导致编辑产物纯度低下,基因编辑的精确性差。为了解决基于CRISPR/Cas系统进行碱基编辑过程中存在的问题,需要持续不断地对其进行优化,以降低off target、降低Indel、缩小编辑窗口,提高编辑特异性以及编辑产物的纯度。
目前已经建立的碱基编辑器(BE)的连续定向进化已经在细菌细胞中取得成功,但在哺乳动物细胞中尚未实现。本研究报告了哺乳动物细胞连续定向进化系统(CDEM)的发展。CDEM能使BE以全长的方式与Cas9酶一起进化。利用CDEM进化胞嘧啶碱基编辑器BE3,腺嘌呤碱基编辑器ABEmax和ABE8e的脱氨酶。在BE4结构上进化的胞苷脱氨酶变异体不仅显示出狭窄的编辑窗口,而且具有更高的编辑纯度和低脱靶活性。进化的ABEmax和ABE8e缩小了编辑窗口或改变了编辑窗口位置,并降低脱靶效应。研究结果表明,CDEM是一种简单而有效的CRISPR/Cas碱基编辑系统定向进化方法,可以在哺乳动物细胞中不受进化片段大小限制的定向连续进化碱基编辑器。
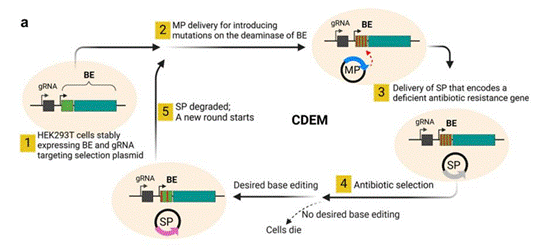
基于CRISPR/Cas碱基编辑器连续定向进化系统(CDEM)的原理示意图

利用CDEM进化胞嘧啶碱基编辑器BE3,在BE4结构上进化的胞苷脱氨酶变异体不仅显示出狭窄的编辑窗口,而且具有更高的编辑纯度和低脱靶活性
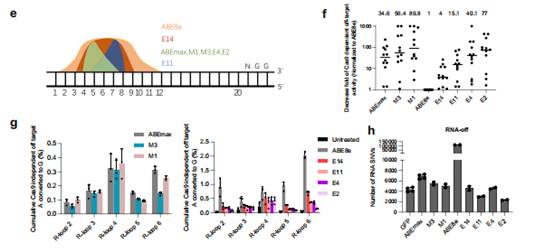
利用CDEM进化腺嘌呤碱基编辑器ABEmax和ABE8e的脱氨酶
原文链接:Zhao N, Zhou J, Tao T, et al. Evolved cytidine and adenine base editors with high precision and minimized off-target activity by a continuous directed evolution system in mammalian cells. Nat Commun. 2024;15(1):8140. doi:10.1038/s41467-024-52483-3.https://doi.org/10.1038/s41467-024-52483-3
